品質への取り組み
2023年1月26日更新

当社のゆるぎない品質システムやそれに基づく原薬や各種試験データの管理など、具体的な品質への取り組みについて「武田テバの品質」ページにてご覧いただくことができます。
信頼性の確保に向けて
武田テバの医薬品へのさらなる信頼性の確保に向けて、新たな取り組みとして「製造販売承認書チェック」*1を行うことといたしました。当社製品を製造する国内外の製剤製造所を対象に製造販売承認書と実際の製造方法・手順との齟齬がないかを自主的に確認するため、2021年3月初旬よりプロジェクトチームを立ち上げ、調査を開始しました。
今後、調査の進捗を当社のウェブサイト上で透明性をもって公開してまいります。
*1 「製造販売承認書チェック」は日本ジェネリック製薬協会と協調した調査です。
製造販売承認書チェックの概要
調査対象
武田テバファーマ株式会社および武田テバ薬品株式会社が製造販売承認を有する、オーソライズド・ジェネリック(AG)を含むジェネリック医薬品*2と長期収載品の製造を委託する国内・海外全ての製剤製造所
*2 2021年2月に日医工株式会社に資産譲渡した製品、また経過措置の製品は除く
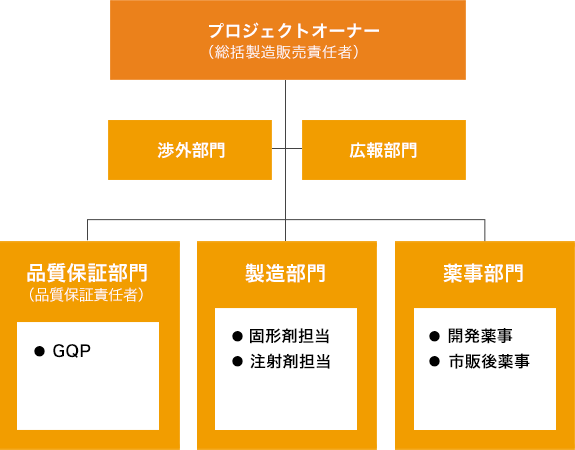
調査体制
武田テバファーマ株式会社および武田テバ薬品株式会社、それぞれの総括製造販売責任者のもと、薬事や品質保証(GQP)といった関連部門で構成するプロジェクトチーム
調査状況
2021年 製造方法・手順
3月より製造販売承認書と実際の製造方法・手順との整合性を点検する「製造販売承認書チェック」を開始し、12月末をもってジェネリック医薬品71品目および長期収載品86品目の調査を予定通りに完了しました。
製造方法・手順の調査完了(2021年)と規格及び試験方法の調査実施(2022年)
〈製造販売元別の調査結果〉
| カテゴリー | 点検 品目数 |
薬事対応が必要と判断した品目数 | 当局相談等により薬事対応が確定している品目数 | 今後当局相談を実施する予定の品目数 | ||
|---|---|---|---|---|---|---|
| 一変申請 | 軽微 変更届 |
|||||
| 武田テバファーマ 株式会社 |
ジェネリック 医薬品 |
64* | 0 | 0 | 0 | 0 |
| 武田テバ薬品 株式会社 |
ジェネリック 医薬品 |
7 | 0 | 0 | 0 | 0 |
| 長期収載品 | 86 | 0 | 0 | 0 | 0 | |
*日本ジェネリック製薬協会の通知「ジェネリック医薬品の信頼性確保に関する対応について」(令和3年3月25日GE薬協会発第25号)に基づく、製造販売承認書自己点検の対象品目
2022年 規格及び試験方法
1月より製造販売承認書と実際の規格及び試験方法との整合性を点検する「製造販売承認書チェック」の準備を開始しました。12月末に完了する予定です。
武田テバは「健康を咲かせる力を」の言葉を胸に、価値ある医薬品をお届けして命の力強さを支え、製薬会社としての責務を果たします。

